Association of the MDR1 Variants (rs2032582 and rs2032583) with Steroid Response in Iraqi Children with Idiopathic Nephrotic Syndrome
DOI:
https://doi.org/10.54133/ajms.v6i2.944الكلمات المفتاحية:
Genetic polymorphisms، Iraq، MDR1، Nephrotic syndrome، Steroid resistanceالملخص
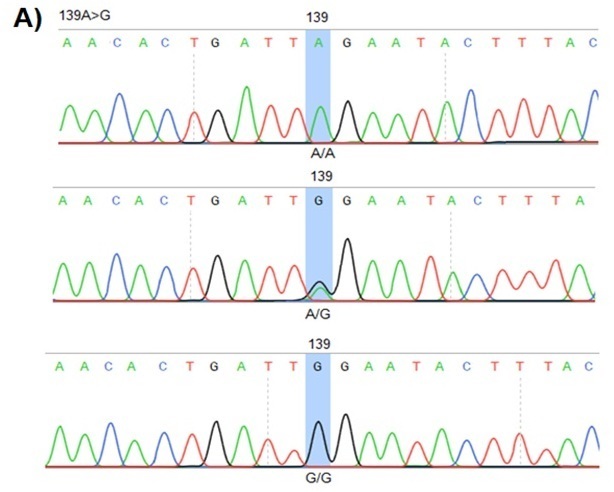
الخلفية: لقد وجدت العديد من الدراسات أن متلازمة التناذر الكلوي المقاومة للأدوية الستيرويدية لها علاقة بالتغيرات الجينية في جين المقاومة للأدوية المتعددة 1، وهناك تباين ملحوظ في نتائج الدراسات بين الأطفال ذوي الأصول العرقية المختلفة. الهدف: في هذا العمل تم دراسة العلاقة بين المتباينات الجينية (rs2032582 و rs2032583) في الجين المقاوم للأدوية المتعدد 1 وخطر الاصابة بمتلازمة التناذر الكلوي المقاومة للأدوية الستيرويدية لدى الاطفال العراقيين الذين يعانون من المتلازمة مجهولة السبب. الطرائق: تم اجراء دراسة الحالات والشواهد وشملت الدراسة مجموعة من الأطفال الذين يعانون من متلازمة التناذر الكلوي المستجيبة للأدوية الستيرويدية (30) و متلازمة التناذر الكلوي المقاومة للأدوية الستيرويدية (30) من مستشفى بابل للولادة وطب الأطفال. تم استخدام التحليل التسلسلي لسانكر لتحديد الأنماط الجينية للمشاركين. النتائج: لم ترتبط الأنماط الجينية والأليلات للمتباينة الجينية (rs2032582) بخطر الاصابة بالمتلازمة المقاومة للأدوية الستيرويدية(p>0.05). علاوة على ذلك، كان الأطفال الذين لديهم مزيج من اي نمط وراثي للمتباينة (rs2032582) مع النمط الجيني المتماثل (الطبيعي أو المتغاير) للمتباينة الجينية (rs2032583) أكثر عرضة للإصابة بالمتلازمة المقاومة للأدوية الستيرويدية مقارنة بأولئك الذين لديهم مزيج من أي نمط وراثي للمتباينة (rs2032582) مع النمط الوراثي المتخالف للمتباينة (rs2032583) حيث كانت نسبة الأرجحية= 30.18 ومدى الثقة 95% (1.55 - 588.5)، ومستوى الدلالة المعنوية الاحصائية (p=0.008). الإستنتاجات: وجدت الدراسة أن الأطفال المصابين بمتلازمة التناذر الكلوي مجهولة السبب و الذين لديهم النمط الوراثي المتماثل (الطبيعي أو المتغاير) للمتباينة الجينية (rs2032583) في الجين المقاوم للأدوية المتعددة 1 من المرجح أن يكونوا مقاومين لعلاج البريدنيزولون، وقد يحتاجون لتداخل علاجي بديل. كما وإن اجراء المزيد من البحوث هو أمر ضروري لأي توضيح اضافي للعلاقة بين التباين الجيني و الإستجابة للخطة العلاجية لدى الأطفال المصابين بمتلازمة التناذر الكلوي مجهولة السبب.
التنزيلات
المراجع
Noone DG, Iijima K, Parekh R. Idiopathic nephrotic syndrome in children. Lancet. 2018;392(10141):61-74. doi: 10.1016/S0140-6736(18)30536-1. DOI: https://doi.org/10.1016/S0140-6736(18)30536-1
Naif MH, Mohammed TF. Clinicopathological features of primary nephrotic syndrome in Iraqi children. Iraqi Postgrad Med J. 2019;65(2):155–160.
Eddy AA, Symons JM. Nephrotic syndrome in childhood. Lancet. 2003;362(9384):629–39.doi: 10.1016/S0140-6736(03)14184-0 DOI: https://doi.org/10.1016/S0140-6736(03)14184-0
Davin JC, Rutjes NW. Nephrotic syndrome in children: from bench to treatment. Int J Nephrol. 2011;2011:372304. doi: 10.4061/2011/372304. DOI: https://doi.org/10.4061/2011/372304
Pasini A, Benetti E, Conti G, Ghio L, Lepore M, Massella L, et al. The Italian Society for Pediatric Nephrology (SINePe) consensus document on the management of nephrotic syndrome in children: Part I - Diagnosis and treatment of the first episode and the first relapse. Ital J Pediatr. 2017;43(1):41. doi: 10.1186/s13052-017-0356-x. DOI: https://doi.org/10.1186/s13052-017-0356-x
Rovin BH, Adler SG, Barratt J, Bridoux F, Burdge KA, Chan TM, et al. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int. 2021;100(4S):S1–276. doi: 10.1016/j.kint.2021.05.021. DOI: https://doi.org/10.1016/j.kint.2021.05.021
Hjorten R, Anwar Z, Reidy KJ. Long-term outcomes of childhood onset nephrotic syndrome. Front Pediatr. 2016;4:53. doi: 10.3389/fped.2016.00053. DOI: https://doi.org/10.3389/fped.2016.00053
Banaszak B, Banaszak P. The increasing incidence of initial steroid resistance in childhood nephrotic syndrome. Pediatr Nephrol. 2012;27(6):927–32. doi: 10.1007/s00467-011-2083-7. DOI: https://doi.org/10.1007/s00467-011-2083-7
Kumar J, Sarwar B, Kishan J, Khan AR, Abdullah MA, Shah SS. Changing Histopathological Trends in Idiopathic Steroid Resistant Nephrotic Syndrome in Pediatric Population. Ann Pak Inst Med Sci. 2021;17(2):146–150. doi: 10.48036/apims.v17i2.456 DOI: https://doi.org/10.48036/apims.v17i2.456
Metz DK, Kausman JY. Childhood nephrotic syndrome in the 21st century: What’s new? J Paediatr Child Health. 2015;51(5):497–504. doi: 10.1111/jpc.12734. DOI: https://doi.org/10.1111/jpc.12734
Ali SH, Hussien FS, Abd Al-Amer H. Profile of renal diseases in Iraqi children: A single-center report. Saudi J Kidney Dis Transpl. 2015;26(3):613–618. doi: 10.4103/1319-2442.157422. DOI: https://doi.org/10.4103/1319-2442.157422
Hasan FO, AlUbaidy MSF, Murad HS. Outcome of idiopathic steroid resistant nephrotic syndrome of children in central child teaching hospital. Karbala J Med. 2022;15(1):2587–2595. DOI: https://doi.org/10.70863/karbalajm.v15i1.1011
Abd Alridha AM, Kadhim D, Alkhazrajy A. The potential of vitamin-D-binding protein as a urinary biomarker to distinguish steroid-resistant from steroid-sensitive idiopathic nephrotic syndrome in Iraqi children. Siriraj Med J. 2023;75(4):248–258. doi: 10.33192/smj.v75i4.260831. DOI: https://doi.org/10.33192/smj.v75i4.260831
Lee JM, Ahn YH, Lim SH, Kang HG. Biomarkers predicting treatment-response in nephrotic syndrome of children: A systematic review. Child Kidney Dis. 2021;25(2):92–111. doi: 10.3339/jkspn.2021.25.2.92. DOI: https://doi.org/10.3339/jkspn.2021.25.2.92
Abd Alridha AM, Kadhim DJ, Alkhazrajy AHA. A cross-sectional study of urinary neutrophil gelatinase-associated lipocalin and its association with steroid responsiveness in Iraqi children with idiopathic nephrotic syndrome. J Fac Med Baghdad. 2023;65(3):163–172.doi: 10.32007/jfacmedbagdad.2049. DOI: https://doi.org/10.32007/jfacmedbagdad.2049
Schijvens AM, Ter Heine R, de Wildt SN, Schreuder MF. Pharmacology and pharmacogenetics of prednisone and prednisolone in patients with nephrotic syndrome. Pediatr Nephrol. 2019;34(3):389–403. doi: 10.1007/s00467-018-3929-z. DOI: https://doi.org/10.1007/s00467-018-3929-z
Laing RE, Hess P, Shen Y, Wang J, Hu SX. The role and impact of SNPs in pharmacogenomics and personalized medicine. Curr Drug Metab. 2011;12(5):460–486.doi: 10.2174/138920011795495268. DOI: https://doi.org/10.2174/138920011795495268
Abd Alridha AM, Al-Gburi KM, Abbood SK. A Review of pharmacogenetics of anticoagulant therapy: Heparins, rivaroxaban, apixaban, and dabigatran. Med J Babylon. 2022;19(3):332–40. doi: 10.4103/MJBL.MJBL_71_22. DOI: https://doi.org/10.4103/MJBL.MJBL_71_22
Abd Alridha AM, Al-Gburi K, Abbood SK. Warfarin therapy and pharmacogenetics: A narrative review of regional and Iraqi studies. Med J Babylon. 2022;19(3):324–331. doi: 10.4103/MJBL.MJBL_70_22. DOI: https://doi.org/10.4103/MJBL.MJBL_70_22
Schwab M, Eichelbaum M, Fromm MF. Genetic polymorphisms of the human MDR1 drug transporter. Annu Rev Pharmacol Toxicol. 2003;43:285–307. doi: 10.1146/annurev.pharmtox.43.100901.140233. DOI: https://doi.org/10.1146/annurev.pharmtox.43.100901.140233
Sakaeda T, Nakamura T, Okumura K. Pharmacogenetics of MDR1 and its impact on the pharmacokinetics and pharmacodynamics of drugs. Pharmacogenomics. 2003;4(4):397–410. doi: 10.1517/phgs.4.4.397.22747. DOI: https://doi.org/10.1517/phgs.4.4.397.22747
Bossennec M, Di Roio A, Caux C, Ménétrier-Caux C. MDR1 in immunity: friend or foe? Oncoimmunology. 2018;7(12):e1499388. doi: 10.1080/2162402X.2018.1499388. DOI: https://doi.org/10.1080/2162402X.2018.1499388
Cuzzoni E, De Iudicibus S, Franca R, Stocco G, Lucafò M, Pelin M, et al. Glucocorticoid pharmacogenetics in pediatric idiopathic nephrotic syndrome. Pharmacogenomics. 2015;16(14):1631–1648. doi: 10.2217/pgs.15.101. DOI: https://doi.org/10.2217/pgs.15.101
Parvin MN, Aziz MA, Rabbi SNI, Al-Mamun MMA, Hanif M, Islam MS, et al. Assessment of the Link of ABCB1 and NR3C1 gene polymorphisms with the prednisolone resistance in pediatric nephrotic syndrome patients of Bangladesh: A genotype and haplotype approach. J Adv Res. 2021;33:141–151. doi: 10.1016/j.jare.2021.02.001. DOI: https://doi.org/10.1016/j.jare.2021.02.001
Han SS, Xu YQ, Lu Y, Gu XC, Wang Y. A PRISMA-compliant meta-analysis of MDR1 polymorphisms and idiopathic nephrotic syndrome: Susceptibility and steroid responsiveness. Medicine (Baltimore). 2017;96(24):e7191. doi: 10.1097/MD.0000000000007191. DOI: https://doi.org/10.1097/MD.0000000000007191
Breitenstein B, Brückl TM, Ising M, Müller-Myhsok B, Holsboer F, Czamara D. ABCB1 gene variants and antidepressant treatment outcome: A meta-analysis. Am J Med Genet B Neuropsychiatr Genet. 2015;168B(4):274–283. doi: 10.1002/ajmg.b.32309. DOI: https://doi.org/10.1002/ajmg.b.32309
Shan XX, Qiu Y, Xie WW, Wu RR, Yu Y, Wu HS, et al. ABCB1 gene is associated with clinical response to SNRIs in a local Chinese Han population. Front Pharmacol. 2019;10:761. doi: 10.3389/fphar.2019.00761. DOI: https://doi.org/10.3389/fphar.2019.00761
Krupoves A, Mack D, Seidman E, Deslandres C, Amre D. Associations between variants in the ABCB1 (MDR1) gene and corticosteroid dependence in children with Crohn’s disease. Inflamm Bowel Dis. 2011;17(11):2308–2317.doi: 10.1002/ibd.21608. DOI: https://doi.org/10.1002/ibd.21608
Schwartz GJ, Muñoz A, Schneider MF, Mak RH, Kaskel F, Warady BA, et al. New equations to estimate GFR in children with CKD. J Am Soc Nephrol. 2009;20(3):629–637. doi: 10.1681/ASN.2008030287. DOI: https://doi.org/10.1681/ASN.2008030287
Musafer KNJ, Huyop FZ, Ewadh MJ, Supriyanto E, Al-Thuwaini TM, Al-Shuhaib MBS. The single nucleotide polymorphisms rs11761556 and rs12706832 of the leptin gene are associated with type 2 diabetes mellitus in the Iraqi population. Arch Biol Sci. 2021;73(1):93–101. doi: 10.2298/ABS210129005M. DOI: https://doi.org/10.2298/ABS210129005M
Shi YY, He L. SHEsis, a powerful software platform for analyses of linkage disequilibrium, haplotype construction, and genetic association at polymorphism loci. Cell Res. 2005;15(2):97–98. doi: 10.1038/sj.cr.7290272. DOI: https://doi.org/10.1038/sj.cr.7290272
Li Z, Zhang Z, He Z, Tang W, Li T, Zeng Z, et al. A partition-ligation-combination-subdivision EM algorithm for haplotype inference with multiallelic markers: update of the SHEsis (http://analysis.bio-x.cn). Cell Res. 2009;19(4):519–523. doi: 10.1038/cr.2009.33. DOI: https://doi.org/10.1038/cr.2009.33
Trautmann A, Vivarelli M, Samuel S, Gipson D, Sinha A, Schaefer F, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2020;35(8):1529–1561. doi: 10.1007/s00467-020-04519-1. DOI: https://doi.org/10.1007/s00467-020-04519-1
Tullus K, Webb H, Bagga A. Management of steroid-resistant nephrotic syndrome in children and adolescents. Lancet Child Adolesc Health. 2018;2(12):880–890.doi: 10.1016/S2352-4642(18)30283-9. DOI: https://doi.org/10.1016/S2352-4642(18)30283-9
Youssef DM, Attia TA, El-Shal AS, Abduelometty FA. Multi-drug resistance-1 gene polymorphisms in nephrotic syndrome: impact on susceptibility and response to steroids. Gene. 2013;530(2):201–207. doi: 10.1016/j.gene.2013.08.045. DOI: https://doi.org/10.1016/j.gene.2013.08.045
Gooding JR, Agrawal S, McRitchie S, Acuff Z, Merchant ML, Klein JB, et al. Predicting and defining steroid resistance in pediatric nephrotic syndrome using plasma metabolomics. Kidney Int Rep. 2020;5(1):81–93. doi: 10.1016/j.ekir.2019.09.010. DOI: https://doi.org/10.1016/j.ekir.2019.09.010
Reference SNP (rs) Report: rs2032583 [Report on the Internet]. The National Center for Biotechnology Information. dbSNP Short Genetic Variations. 2022 [cited 2024 Feb 11]. Available from: https://www.ncbi.nlm.nih.gov/snp/rs2032583
Sauna ZE, Kimchi-Sarfaty C, Ambudkar SV, Gottesman MM. Silent polymorphisms speak: How they affect pharmacogenomics and the treatment of cancer. Cancer Res. 2007;67(20):9609–12. doi: 10.1158/0008-5472.CAN-07-2377. DOI: https://doi.org/10.1158/0008-5472.CAN-07-2377
Reference SNP (rs) Report: rs2032582 [Internet]. The National Center for Biotechnology Information. dbSNP Short Genetic Variations. 2022 [cited 2024 Jun 10]. Available from: https://www.ncbi.nlm.nih.gov/snp/rs2032582#frequency_tab
Cizmarikova M, Podracka L, Klimcakova L, Habalova V, Boor A, Mjzis J, et al. MDR1 polymorphisms and idiopathic nephrotic syndrome in Slovak children: preliminary results. Med Sci Monit. 2015;21:59–68. doi: 10.12659/MSM.891366. DOI: https://doi.org/10.12659/MSM.891366
Choi HJ, Cho HY, Ro H, Lee SH, Han KH, Lee H, et al. Polymorphisms of the MDR1 and MIF genes in children with nephrotic syndrome. Pediatr Nephrol. 2011;26(11):1981–1988. doi: 10.1007/s00467-011-1903-0. DOI: https://doi.org/10.1007/s00467-011-1903-0
Abd Alridha AM, Kadhim DJ, Alkhazrajy AHA. Association of the rs118503 and rs1045642 polymorphisms in the MDR-1 gene with steroid responsiveness in Iraqi children with idiopathic nephrotic syndrome. Pharm Sci Asia. 2023;50(3):187–195. doi: 10.29090/psa.2023.03.23.245. DOI: https://doi.org/10.29090/psa.2023.03.23.245
Yates CM, Sternberg MJE. The Effects of Non-synonymous single nucleotide polymorphisms (nsSNPs) on protein–protein interactions. J Mol Biol. 2013;425(21):3949–3963. doi: 10.1016/j.jmb.2013.07.012. DOI: https://doi.org/10.1016/j.jmb.2013.07.012
التنزيلات
منشور
كيفية الاقتباس
إصدار
القسم
الرخصة
الحقوق الفكرية (c) 2024 Al-Rafidain Journal of Medical Sciences

هذا العمل مرخص بموجب Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
Published by Al-Rafidain University College. This is an open access journal issued under the CC BY-NC-SA 4.0 license (https://creativecommons.org/licenses/by-nc-sa/4.0/).










