متلازمة تكيس المبايض وحصوات المسالك البولية: تحليل معدل حسب مؤشر كتلة الجسم لدى النساء العراقيات
DOI:
https://doi.org/10.54133/ajms.v8i1.1725الكلمات المفتاحية:
متلازمة تكيس المبايض، حصوات المسالك البولية، مؤشر كتلة الجسم، نقص الوزن، زيادة الوزن، السمنةالملخص
الخلاصة:
الخلفية: متلازمة تكيس المبايض (PCOS) لها سبب غير معروف ومعقد. وهي تؤثر على 5-10٪ من النساء في سن الإنجاب. ومن المعروف أن المرضى يعانون من زيادة إنتاج الأندروجين في المبيض المرتبط بانخفاض الدورة الشهرية وكثرة الشعر وحب الشباب. حصوات المسالك البولية هي اضطراب متعدد العوامل، حيث يعتبر العمر والجنس من عوامل الخطر المعروفة. يعاني العديد من مرضى متلازمة تكيس المبايض من السمنة، وقد تم إثبات وجود روابط بين حصوات الكلى والسمنة مسبقًا.
الأهداف: تحديد العلاقة بين متلازمة تكيس المبايض وحصوات المسالك البولية مع مراعاة مؤشر كتلة الجسم (BMI) لدى المرضى.
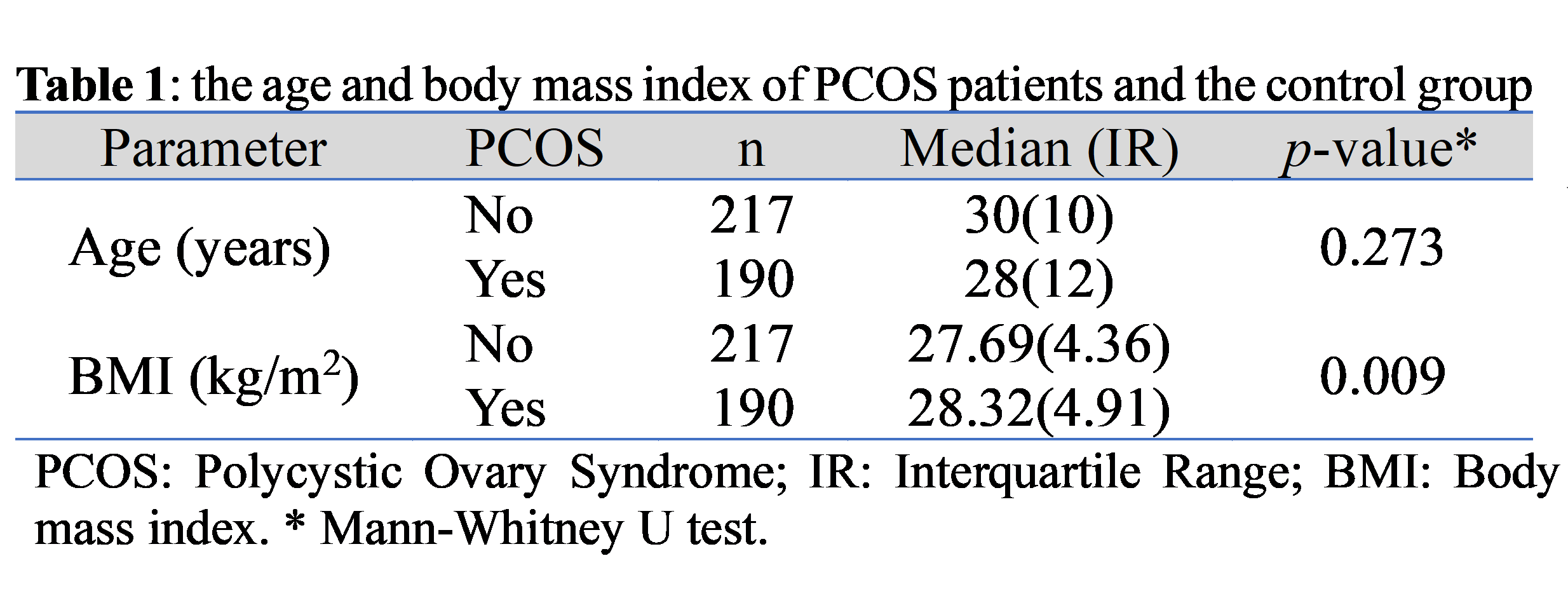
الطريقة والمرضى: هذه دراسة مقطعية شملت 407 امرأة تتراوح أعمارهن بين 18 و40 عامًا، حضرن عيادة أمراض النساء والتوليد في مستشفى العلوية التعليمي للولادة. تم توزيع المريضات على مجموعة متلازمة تكيس المبايض أو مجموعة التحكم. تتضمن البيانات التي تم جمعها العمر والوزن والطول ومؤشر كتلة الجسم (BMI) ونتائج الموجات فوق الصوتية للبطن للكشف عن حصوات المسالك البولية.
النتائج: كان هناك مائة وتسعون امرأة في مجموعة متلازمة تكيس المبايض و217 في مجموعة التحكم. كان مؤشر كتلة الجسم لدى مجموعة متلازمة تكيس المبايض أعلى من مجموعة التحكم. كان مؤشر كتلة الجسم لدى المرضى المصابين بمتلازمة تكيس المبايض أعلى من أولئك الذين لا يعانون من حصوات المسالك البولية. أظهرت متلازمة تكيس المبايض مع مؤشر كتلة الجسم الأعلى زيادة خطر الإصابة بـ حصوات المسالك البولية. ومع ذلك، أظهر تحليل كل من المتغيرات مع الأخذ في الاعتبار الآخر عدم وجود ارتباط كبير.
الخلاصة: تزيد متلازمة تكيس المبايض ومؤشر كتلة الجسم من فرص الإصابة بـ حصوات المسالك البولية، ومع ذلك، لم يظهر أي منهما ارتباطًا كبيرًا عند التحكم في الآخر.
التنزيلات
المراجع
Kaygusuz I, Karatas OF, Kafali H, Cimentepe E, Unal D. Is polycystic ovarian syndrome a risk factor for urolithiasis? Urolithiasis. 2013;41(4):361-362. doi: 10.1007/s00240-013-0564-9. DOI: https://doi.org/10.1007/s00240-013-0564-9
Adashi EY, Cibula D, Peterson M, Azziz R. The polycystic ovary syndrome: the first 150 years of study. F S Rep. 2022;4(1):2-18. doi: 10.1016/j.xfre.2022.12.002. DOI: https://doi.org/10.1016/j.xfre.2022.12.002
Singh S, Pal N, Shubham S, Sarma DK, Verma V, Marotta F, et al. Polycystic ovary syndrome: Etiology, current management, and future therapeutics. J Clin Med. 2023;12(4):1454. doi: 10.3390/jcm12041454. DOI: https://doi.org/10.3390/jcm12041454
Aziz ZN-E, Saleh BO, Thaker AZ. Free testosterone, dihydrotestosterone, and adiponectin in the evaluation of vitamin D supplementation for polycystic ovarian syndrome: A metformin comparative study. Al-Kindy Coll Med J. 2024;20(3):239-244. DOI: https://doi.org/10.47723/nb5he078
Abdull TN. Step-up protocol gonadotrophin versus laparoscopic ovarian drilling in clomiphene citrate resistant PCOS infertile women in two Iraqi hospitals. Al-Kindy Coll Med J. 2019;15(1):103-109. DOI: https://doi.org/10.47723/kcmj.v15i1.89
Bellver J, Rodríguez-Tabernero L, Robles A, Muñoz E, Martínez F, Landeras J, et al. Polycystic ovary syndrome throughout a woman's life. J Assist Reprod Genet. 2018;35(1):25-39. doi: 10.1007/s10815-017-1047-7. DOI: https://doi.org/10.1007/s10815-017-1047-7
Legro RS, Strauss JF. Molecular progress in infertility: polycystic ovary syndrome. Fertil Steril. 2002;78(3):569–576. doi: 10.1016/s0015-0282(02)03275-2. DOI: https://doi.org/10.1016/S0015-0282(02)03275-2
Rasquin LI, Anastasopoulou C, Mayrin JV. Polycystic ovarian disease. 2022 Nov 15. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2024. PMID: 29083730.
Azziz R. Polycystic ovary syndrome. Obstet Gynecol. 2018;132(2):321-336. doi: 10.1097/AOG.0000000000002698. DOI: https://doi.org/10.1097/AOG.0000000000002698
Rostami Dovom M, Rahmati M, Amanollahi Soudmand S, Ziaeefar P, Azizi F, Ramezani Tehrani F. The hidden link between polycystic ovary syndrome and kidney stones: Finding from the Tehran Lipid and Glucose Study (TLGS). Diagnostics (Basel). 2023;13(17):2814. doi: 10.3390/diagnostics13172814. DOI: https://doi.org/10.3390/diagnostics13172814
Tahir NL, Hassan QA, Kamber HM. The prevalence of a clinically silent nephrolithiasis in Baghdad population: An initial ultrasound screening study from Iraq. Acta Medica Iranica. 2019:51-56. doi: 10.18502/acta.v57i1.1753. DOI: https://doi.org/10.18502/acta.v57i1.1753
Almannie RM, Al-Nasser KA, Al-Barraq KM, Alsheheli MM, Al-Hazmi HH, Binsaleh SA, et al. The effect of the body mass index on the types of urinary tract stones. Urol Ann. 2020;12(1):42-48. doi: 10.4103/UA.UA_161_18. DOI: https://doi.org/10.4103/UA.UA_161_18
Mosli HA, Mosli HH. Increased body mass index is associated with larger renal calculi. Urology. 2012;80:974-977. doi: 10.1016/j.urology.2012.07.027. DOI: https://doi.org/10.1016/j.urology.2012.07.027
Del Valle EE, Negri AL, Spivacow FR, Rosende G, Forrester M, Pinduli I. Metabolic diagnosis in stone formers in relation to body mass index. Urol Res. 2012;40(1):47-52. doi: 10.1007/s00240-011-0392-8. DOI: https://doi.org/10.1007/s00240-011-0392-8
Puttabyatappa M, Padmanabhan V. Ovarian and extra-ovarian mediators in the development of polycystic ovary syndrome. J Mol Endocrinol. 2018;61(4):R161-R184. doi: 10.1530/JME-18-0079. DOI: https://doi.org/10.1530/JME-18-0079
Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004;19(1):41-47. doi: 10.1093/humrep/deh098. DOI: https://doi.org/10.1093/humrep/deh098
Skolarikos A, Jung H, Neisius A, Petřík A, Somani B, Tailly T, et al. EAU Guidelines on Urolithiasis 2024. European Association of Urology 2024. Available from: https://uroweb.org/guidelines/urolithiasis
Cohen J. Statistical power analysis for the behavioral sciences. Routledge; 2013. doi: 10.4324/9780203771587. DOI: https://doi.org/10.4324/9780203771587
Fedrigon D, Alazem K, Sivalingam S, Monga M, Calle J. Nephrolithiasis and polycystic ovary syndrome: A case-control study evaluating testosterone and urinary stone metabolic panels. Adv Urol. 2019;2019:3679493. doi: 10.1155/2019/3679493. DOI: https://doi.org/10.1155/2019/3679493
Zhu X, Kaygusuz I, Eser A, Yildirim ME, Çimentepe E, Yüce E, et al. Is polycystic ovarian syndrome a risk factor for urinary stone disease? Clin Oncol. 2018;3:1443.
Jalilian N, Haghnazari L, Rasolinia S. Leptin and body mass index in polycystic ovary syndrome. Indian J Endocrinol Metab. 2016;20(3):324-328. doi: 10.4103/2230-8210.180005. DOI: https://doi.org/10.4103/2230-8210.180005
Fang Y, Liu L, Yang Y, Zhang B, Xie S. Causal association between BMI and polycystic ovarian syndrome: Bidirectional 2-sample mendelian randomization study. J Clin Endocrinol Metab. 2024;110(1):41-47. doi: 10.1210/clinem/dgae446. DOI: https://doi.org/10.1210/clinem/dgae446
Feng X, Wu W, Zhao F, Xu F, Han D, Guo X, et al. Relationship between body mass index and kidney stones based on dose-response analyses using restricted cubic splines applied to NHANES 2011-2016 data. J Ren Nutr. 2021;31(3):263-269. doi: 10.1053/j.jrn.2020.05.003. DOI: https://doi.org/10.1053/j.jrn.2020.05.003
Güler Y. Effects of body mass index on urinary lithogenic factors in urinary system stone patients. Folia Med (Plovdiv). 2024;66(1):80-87. doi: 10.3897/folmed.66.e114369. DOI: https://doi.org/10.3897/folmed.66.e114369
التنزيلات
منشور
كيفية الاقتباس
إصدار
القسم
الرخصة
الحقوق الفكرية (c) 2025 Al-Rafidain Journal of Medical Sciences

هذا العمل مرخص بموجب Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
Published by Al-Rafidain University College. This is an open access journal issued under the CC BY-NC-SA 4.0 license (https://creativecommons.org/licenses/by-nc-sa/4.0/).










